Penanganan Virus Corona
BPOM Terbitkan Ijin Obat Covid-19, Ini Perbedaan Remdesivir dan Favipiravir, Hanya untuk Darurat
Badan POM juga mewajibkan industri farmasi selaku pemilik EUA melakukan farmakovigilans melalui pemantauan dan pelaporan efek samping obat
Penulis: Siti Fatimah | Editor: Siti Fatimah
TRIBUNJABA.ID,BANDUNG - Saat ini telah ditemukan beberapa obat yang terbukti melalui uji klinik menunjukkan kemanfaatannya dalam menyembuhkan pasien COVID-19.
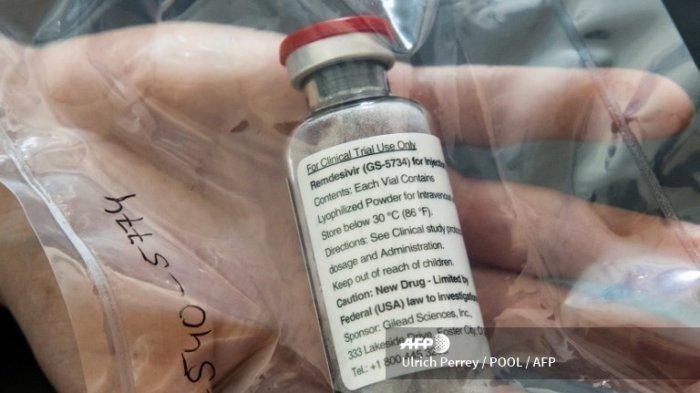
Kedua obat Covid-19 ini berbeda peruntukannya, Favipiravir untuk pasien derajat ringan dan sedang yang dirawat di rumah sakit sedangkan Remdesivir untuk pasien derajat berat yang dirawat di rumah sakit.
Sejak 3 September 2020 Badan POM telah terbitkan izin obat Covid-19 untuk penggunaan dalam kondisi darurat (Emergency Use Authorization/EUA) Favipiravir kepada Industri Farmasi PT. Beta Pharmacon (Dexa Group) dengan merek dagang Avigan® dan kepada PT. Kimia Farma Tbk. yang saat ini sudah memproduksi produk generik Favipiravir di Indonesia.
• INI PENYEBABNYA, Terjadi Peningkatan Kunjungan Pasien Gangguan Cemas di RSJ di Masa Pandemi Covid-19
Sedangkan untuk Remdesivir, telah diberikan EUA sejak tanggal 19 September kepada Industri Farmasi PT. Amarox Pharma Global, PT. Indofarma, dan PT. Dexa Medica.
EUA merupakan persetujuan penggunaan obat atau vaksin saat kondisi darurat kesehatan masyarakat, dalam hal ini pandemi COVID-19.
Terhadap produk yang telah mendapatkan EUA, Badan POM terus melakukan pengawasan penyaluran dan peredaran sejak dari industri farmasi, pedagang besar farmasi, dan sarana pelayanan kefarmasian.
Pengawasan dapat dilakukan melalui evaluasi pelaporan realisasi importasi, produksi dan distribusi obat yang disampaikan kepada Badan POM.
Selain itu, Badan POM juga mewajibkan industri farmasi selaku pemilik EUA untuk menjamin mutu obat, melakukan uji klinik di Indonesia untuk memastikan khasiat dan keamanan obat, serta melakukan farmakovigilans melalui pemantauan dan pelaporan efek samping obat yang harus disampaikan kepada Badan POM.
• Demo Tolak UU Cipta Kerja di Purwakarta Ricuh, Gedung DPRD Berantakan Dilempari Batu
Hal-hal tersebut merupakan upaya Badan POM dalam melindungi masyarakat berupa pemastian keamanan, khasiat, dan mutu obat yang beredar.
Kepala Badan POM RI, Penny K. Lukito mengatakan, penerbitan EUA diharapkan dapat memberikan percepatan akses obat-obat yang dibutuhkan dalam penanganan COVID-19 oleh para dokter sehingga mempunyai pilihan pengobatan yang sudah terbukti khasiat dan keamanannya dari uji klinik.
Dengan tersedianya obat-obat tersebut diharapkan dapat meningkatkan angka kesembuhan dan menurunkan angka kematian pasien COVID-19 yang menjadi target pemerintah dalam percepatan penanganan COVID-19.
“Semoga para dokter dan tenaga kesehatan lain bekerja sama untuk berpartisipasi aktif dalam pemantauan terhadap khasiat dan keamanan melalui kegiatan Farmakovigilans,” katanya. dikutip Tribun dari siaran pers BPOM, Rabu (7/10/2020).
Farmakovigilans merupakan kegiatan pemantauan dan pelaporan kejadian tidak diinginkan dan/atau efek samping obat pada pasien oleh dokter dan tenaga kesehatan lainnya di fasilitas pelayanan kesehatan.
• Calon Penumpang Bus Budiman Geger, Ada Mayat di WC Pool Bus, Ini Identitasnya
Semua laporan tersebut diterima oleh Badan POM dan dievaluasi secara periodik.
Apabila terdapat peningkatan frekuensi efek samping, maka Badan POM dapat melakukan tindak lanjut dengan memberikan komunikasi risiko dan pencabutan EUA untuk meningkatkan kehati-hatian dalam penggunaan dan perlindungan kesehatan masyarakat.